-
화학전지란? (1) 1차전지과학 잡지/용어 현상 사례 2021. 9. 9. 12:00728x90반응형
화학전지
자발적인 산화(Oxidation), 환원(reduction), 반응(redox reaction)에 의해 화학 에너지를 직접 변환시키는 장치
1. 구성
음극과 양극, 전해질(주로 고체전해질 사용 시)
or 음극, 양극, 전해액 및 세퍼레이터(주로 액체전해질 사용 시)
-음극(anode): 산화되는 전극(이온화 경향이 큰 금속)
-양극(cathode): 환원되는 전극(이온화 경향이 작은 금속)
-산화: 산소와 화학적으로 직접 결합
전자를 잃는 것
-환원: 전자를 얻는 것
-이온화경향: 용액 속(주로 수용액 속)에서 원소(주로 금속)의 이온이 되기 쉬움을 나타냄
2. 종류
(1) 1차 전지
방전한 후에 충전을 통해 원래의 상태로 되돌릴 수 없는 전지_사용 후 재사용 불가
(2) 볼타 전지
아연판(음극)과 구리판(양극)을 두 극으로 사용하고 묽은 황산을 전해액으로 하는 간단한 전지
-아연이 산화되어 전자를 내어놓고 전자는 전위차에 의해 구리판으로 이동(반복하여 전류가 흐르게 됨)
-약 1V의 기전력을 얻을 수 있음
*큰 전압을 얻기 힘든 이유
-1단계: 전자가 구리판에서 용액 속의 수소 이온에 환원되면서 수소 기체 발생
-2단계: 수소 기포가 달라붙는 분극 현상이 발생
-3단계: 전자의 흐름 방해

볼타전지 출처: 과학 사이언스올 요약

화학전지식 
음극 
양극 
전체반응
(3) 다니엘 전지
기본 원리는 볼타 전지와 같다
각각의 금속을 금속 이온 용액에 담그고, 두 이온 용액을 다공성세라믹 분리막으로 나누는 전지구성
산화전극(-극): Zn(s) → Zn²+ (aq) + 2e⁻
환원전극(+극): Cu²+ (aq) + 2e⁻ → Cu(s)
전체반응: Zn(s) + Cu²+ (aq) → Zn²+ (aq) + Cu(s)
화학전지식: Zn(s)|Zn²+(aq)||Cu²+ (aq)|Cu(s)

다니엘 전지 출처: 해시넷 
음극 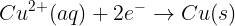
양극 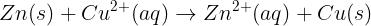
전체반응 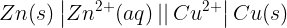
화학전지식
(4) 건전지
액체 전해질을 개선한 유동성이 없는 수용성 전해질을 넣어 만든 전지
*구조
바깥쪽은 음극인 아연이 용기를 겸하고, 중앙에는 양극인 탄소막대가 존재
탄소막대 주위에는 이산화망간과 흑연을 섞은 물질을 고압압착시켜 채워져있음
그 물질을 전해질(염화암모늄)을 흡수시킨 종이로 덮음
-이상화망간: 감극제(소극제)
-감극제(소극제): 환원되는 수소를 제거하는 물질

건전지 구조 출처: SK이노베이션 *원리
-1단계: 외부 도선이 견결되면 아연이 이온화되어 전해질에 녹고 아연통은 (-)극이 된다.

-2단계: 외부 도선이 연결되면 전해질 속의 염화암모늄이 이온화된다.

-3단계: 암모늄이온은 탄소막대에 모이게 되고, 탄소막대에서 전자를 얻어 암모니아와 수소로 분해된다.

-4단계: 탄소막대가 전자를 잃어 (+)극 상태가 되고 전위차가 발생하여 전류가 흐른다.
-5단계: 발생한 암모니아 기체는 아연-암모니아 착물 이온을 형성하여 암모니아 기체를 없앤다.

*감극제 원리
-이산화망간이 수소 기체와 반응하여 물을 생성하고 수소 기체를 없앤다.
 728x90반응형
728x90반응형'과학 잡지 > 용어 현상 사례' 카테고리의 다른 글
바다의 지속적 온도 상승? 왜 뜨거워질까? (0) 2021.09.11 SI단위(국제단위계)에 대해 알아보자! (0) 2021.09.10 열 및 물질 전달(2) 대류 (0) 2021.09.08 열 및 물질 전달(1) 전도 (0) 2021.09.06 에코 챔버 효과란 무엇일까? (2) 2021.07.03